Противовирусная терапия ОРВИ и гриппа у детей в стационарных условиях
2 Санкт-Петербургский государственный педиатрический медицинский университет, Санкт-Петербург, Россия;
3 Военно-медицинская академия им. С.М. Кирова, Санкт-Петербург, Россия
2 Saint-Petersburg State Pediatric Medical University, Saint-Petersburg, Russia;
3 Military Medical Academy named after S.M. Kirov, Saint-Petersburg, Russia
Резюме
Цель: изучить эффективность и безопасность противовирусной терапии гриппа и ОРВИ препаратом Кагоцел у детей в условиях стационара.
Материалы и методы: в наблюдательное исследование включено 80 детей в возрасте от 3 до 11 лет, госпитализированных с симптомами гриппа и ОРВИ. Этиологическое подтверждение диагноза проводилось методом ПЦР на основании исследования мазков из носовых ходов. Препарат Кагоцел назначали согласно инструкции по применению в течение первых суток госпитализации. Анализ вирусовыделения после курса терапии препаратом Кагоцел (на 5–6-е сутки от начала лечения) проводили только у пациентов с верифицированными гриппом и ОРВИ.
Результаты. Установлена доминирующая этиологическая роль вирусов в развитии острых респираторных инфекций у детей в возрасте от 3 до 11 лет в период подъема заболеваемости в Санкт-Петербурге с сентября 2015 г. по май 2016 г., при этом 25% от общего числа пациентов были больны гриппом А и/или В. Показано достоверное снижение лихорадки к 3-м суткам (p<0,001) и нормализация температуры тела к 4-м суткам от начала терапии препаратом Кагоцел, как в общей группе, так и у пациентов с подтвержденным диагнозом «грипп». Синдром интоксикации, максимально выраженный при гриппе, преимущественно купировался к 4-м суткам (р<0,001). Катаральный синдром, превалировавший в общей группе ОРВИ, имел более длительные сроки клинического проявления и на фоне проводимой терапии был полностью нивелирован к 3–7-м суткам терапии. Негативные результаты ПЦР после курса терапии Кагоцелом были зарегистрированы у 57,1% в общей группе пациентов. Среди всех выявленных патогенов наиболее характерно было отсутствие повторного выделения вирусов гриппа В и А, РС-вируса (86% и 53,8%, 71,4% соответственно), элиминация риновирусов наблюдалась реже (33,3%).
Заключение. по результатам проведенного исследования установлена эффективность терапии с включением препарата Кагоцел в купировании лихорадки к 3–4-м суткам лечения, а также интоксикационного синдрома к 5–6-м суткам у больных острыми респираторными вирусными инфекциями, в том числе у пациентов с гриппом. Негативация результатов ПЦР на момент завершения терапии имела место преимущественно у больных гриппом А и В, РС-инфекцией. Нежелательных явлений не отмечалось.
Ключевые слова: грипп, этиология ОРВИ, дети, индуктор интерферонов, ПЦР.
Abstract
Objective: to study the efficacy and safety of antiviral therapy for influenza and acute respiratory viral infection with Kagocel in children in a hospital.
Materials and methods: in the observational study included 80 children aged 3 to 11 years, hospitalized with symptoms of influenza and acute respiratory viral infection. The etiological confirmation of the diagnosis was carried out by the PCR method based onthe study of nasal swabs.The drug Kagocel was administered according to the instructions for use during the first 24 hours of hospitalization.The analysis of the virus release after the course of therapy with Kagocel (at 5–6 days from the beginning of treatment) was carried out only in patients with verified influenza and acute respiratory viral infection.
Results: the dominant influence of viruses in the development of acute respiratory infections in children aged 3 to 11 years in the period of rising morbidity in St. Petersburg from September 2015 to May 2016. At the same time, 25% of the total number of patients were sick with influenza A and/or B. There was a significant decrease in fever to the third day (p <0,001) and normalization of body temperature from the fourth day after the beginning of therapy with Kagocel in the general group and in patients with confirmed influenza diagnosis. The intoxication syndrome, most pronounced with the flu, was mostly stopped by the fourth day (р<0,001). Catarrhal syndrome, prevalent in the general group of acute respiratory viral infection, had longer periods of clinical manifestation and against the background of the therapy completely eliminated to the third or seventh day of therapy.Negative PCR results after the course of Kagocel therapy were established in 57,1% of the total group of patients. Among all detected viruses, the most typical is the absence of repeated isolation of influenza B and A viruses, PC virus (86% and 53,8%, 71,4%, respectively), the elimination of rhinoviruses was less frequent (33,3%).
Conclusion: according to the results of the study, the effectiveness of therapy with the inclusion of the drug Kagocel in relieving fever by 3–4 days of treatment, as well as intoxication syndrome by 5–6 days in patients with acute respiratory viral infections, including patients with influenza, has been established. Negative results of PCR at the time of completion of therapy occurred mainly in patients with influenza A and B, PC infection. No adverse events were noted.
Key words: influenza, etiology of acute respiratory viral infection, children, interferon inducer, PCR.
Введение
Вирусные инфекции дыхательных путей являются наиболее распространенными заболеваниями у людей любого возраста и обусловливают значительную часть острой патологии во всех возрастных группах. Ежегодно дети переносят 6–8 эпизодов острого респираторного вирусного заболевания (ОРВИ)[1].
Некоторые вирусы циркулируют постоянно и вызывают заболевания круглый год. Одним из таких вирусов является риновирус как наиболее часто идентифицируемый этиологический агент. Другие респираторные вирусы, такие как грипп, респираторно-синцитиальный вирус, характеризуются сезонностью и распространены преимущественно в зимне-весенние месяцы[2, 3]. Для энтеровирусов основным временем активности является летний период и начало осени. Вирусы парагриппа, коронавирусы, метапневмовирусы, аденовирусы не имеют четкой сезонности и регистрируются в течение всего года. Несмотря на то, что респираторные вирусы вносят существенный вклад в развитие респираторной патологии у детей, этиологию ОРВИ верифицируют редко в связи с невозможностью применения ПЦР в амбулаторной практике и в большинстве стационаров, а также, в связи с отсутствием доступных практическому здравоохранению экспресс-тестов отечественного производства[4, 5].
Важной эпидемиологической особенностью является одномоментная циркуляция разных типов и штаммов вирусов, в том числе и вирусов гриппа, а также наличие сочетанных инфекций (гриппа и других респираторных вирусных инфекций) во всех странах мира[6]. Хотя для каждой вирусной инфекции характерны определенные клинические особенности, при сочетанных инфекциях сглаживаются клинические различия этиологических форм респираторных инфекций. Это приводит к необоснованному назначению специфических противогриппозных препаратов у больных с ОРВИ негриппозной этиологии, а также снижает эффективность противовирусной терапии гриппа ингибиторами М2-каналов вирусов гриппа А и ингибиторами нейраминидазы у пациентов, в том числе с сочетанной вирусно-вирусной этиологией из-за нечувствительности к ним респираторных негриппозных вирусов.
Острые вирусные инфекции способны поражать эпителий не только верхних, но и нижних дыхательных путей, с развитием клинических проявлений в виде ринита, ларинготрахеита, простого и обструктивного бронхита, вирусной пневмонии. При этом основная опасность их заключается в способствовании формированию осложнений, в том числе вирусных и вирусно-бактериальных пневмоний, бронхиолита с развитием дыхательной недостаточности, а также острого среднего отита, синусита и других осложнений, предотвращение и лечение которых затруднено из-за отсутствия специфических противовирусных препаратов для лечения заболеваний негриппозной этиологии.
Дети, особенно раннего возраста, остаются наиболее уязвимой группой пациентов, т.к. у них происходит формирование еще незрелых собственных иммунных механизмов. Иммунокомпетентные клетки синтезируют α-интерфероны у детей в ответ на проникновение вируса в 10 раз меньше, чем у взрослых[7]. Важной проблемой, требующей решения, является поиск наиболее эффективных и безопасных средств терапии респираторных вирусных инфекций с достаточным клиническим эффектом при отсутствии побочных явлений.
Препарат отечественного производства, индуктор интерферонов Кагоцел, в многочисленных исследованиях показал эффективность при лечении гриппа и ОРВИ у детей с 3-летнего возраста при отсутствии побочных эффектов[8, 9, 10, 11]. Кагоцел (ООО «НИАРМЕДИК ПЛЮС», Россия, регистрационный номер Р N002027/01 от 19.11.07) является высокомолекулярным соединением, синтезированным на основе натриевой соли карбоксиметилцеллюлозы и низкомолекулярного природного полифенола, получаемого из растительного сырья (хлопчатника) путем химического синтеза.
Препарат индуцирует образование в организме человека «поздних» интерферонов (ИФН), являющихся сочетанием D- и E-интерферонов, которые обладают высокой противовирусной активностью и длительно циркулируют в кровотоке. Кагоцел приводит к продукции ИФН большинством клеточных популяций, задействованных в противовирусном ответе: Т- и В-лимфоцитами, макрофагами, гранулоцитами, эндотелиальными клетками и фибробластами. Препарат Кагоцел при назначении в терапевтических дозах не токсичен, не канцерогенен и не накапливается в организме.
Цель исследования – изучить эффективность и безопасность противовирусной терапии гриппа и ОРВИ препаратом Кагоцел у детей в условиях стационара.
Материалы и методы
Проведение наблюдательной научно-исследовательской работы было рассмотрено и одобрено локальным этическим комитетом Научно-исследовательского института детских инфекций 14.04.2015 г.
Исследование проводили в течение эпидемического сезона гриппа и ОРВИ в период с 11 сентября 2015 г. по 5 мая 2016 г. В группу включено 80 детей в возрасте от 3 до 11 лет включительно с симптомами гриппа и ОРВИ независимо от сроков заболевания и при отсутствии в анамнезе аллергии и/или повышенной чувствительности к компонентам препарата Кагоцел. В исследование не включались пациенты, получавшие в течение 15 дней до госпитализации противовирусные и иммуномодулирующие препараты. Диагноз ОРВИ ставили клинически вне зависимости от связи с эпидемическим сезоном. Этиологическая верификация диагноза проводилась на основании исследования мазков из носовых ходов методом полимеразной цепной реакции (ПЦР) в первые сутки госпитализации. Из 80 детей только у одного была проведена вакцинация от гриппа.
Анализ клинической эффективности противовирусной терапии проводили на основании динамики выраженности и длительности лихорадки, интоксикации, катарального синдрома с учетом шкалы оценки выраженности симптомов гриппа и ОРВИ. Качественные признаки оценивали в баллах: отсутствие признака – 0 баллов, слабо выраженный признак – 1 балл, средне (умеренно) выраженный – 2 балла, ярко (сильно) выраженный – 3 балла. Для оценки динамики интоксикационного и катарального синдромов использовали совокупную оценку баллов с учетом всех симптомов. Сопоставления проводили между больными с лабораторно подтвержденным гриппом (n=20) и общей группой наблюдаемых пациентов с ОРВИ (n=80).
Противовирусный препарат Кагоцел назначали в сочетании с симптоматической терапией текущего эпизода ОРВИ или гриппа согласно инструкции по применению: детям в возрасте 3–5 лет 2 дня по 1 таблетке 2 раза в день, 2 дня по 1 таблетке 1 раз в день. Курс лечения составлял 6 таблеток в течение 4 дней; детям 6–11 лет – 2 дня по 1 таблетке 3 раза в день, 2 дня по 1 таблетке 2 раза в день. Курс составлял 10 таблеток в течение 4 дней. При подозрении на бактериальный характер осложнений пациенты дополнительно получали антибактериальные препараты.
Дети наблюдались до момента выписки из стационара. Общий период наблюдения составил не менее 7 суток. Анализ вирусовыделения после курса терапии препаратом Кагоцел проводили только у пациентов с верифицированными гриппом и ОРВИ негриппозной этиологии (на 5–6-е сутки от начала лечения).
Выявление респираторных вирусов в мазках из носовых ходов проводили методом мультиплексной ПЦР с гибридизационно-флуоресцентной детекцией продуктов амплификации с использованием наборов реагентов «АмплиСенс® Influenzavirus A/B-FL» и «АмплиСенс® ОРВИскрин-FL» (ФБУН ЦНИИ эпидемиологии Роспотребнадзора, Россия), которые обеспечивают выявление специфических фрагментов нуклеиновых кислот (НК) гриппа А и гриппа В и других возбудителей ОРВИ: РНК человеческого респираторносинцитиального вируса, вирусов парагриппа 1–4 типов, человеческих коронавирусов, человеческого метапневмовируса, человеческих риновирусов, а также ДНК человеческих аденовирусов групп B, C, E и бокавирусов.
Математико-статистическая обработка данных исследования осуществлена с помощью модулей «Анализ данных» и «Мастер диаграмм» табличного редактора Excel, а также модулей Basic Statistics / Tables (Базовые статистики и таблицы) и ANOWA (дисперсионный анализ) пакета программ по статистической обработке данных Statistica for Windows. Оценка значимости различия средних значений и частоты проявления признаков в различных группах больных проводилась с помощью параметрического метода оценки гипотез параметрического t-критерия Стьюдента. Изучение связи между признаками осуществлялось с помощью параметрического коэффициента корреляции r Пирсона и непараметрического критерия F2 -Пирсона. Оценка степени влияния качественных факторов, отградуированных на 3 и более уровнях, на количественный признак-отклик проводилась с помощью однофакторного и многофакторного дисперсионного анализа, алгоритм которого обеспечивает расчет средних значений количественного признака-отклика для различных уровней факторов и их взаимодействия. Результат решения представлялся в табличном и графическом виде с указанием 95% доверительных интервалов и оценки значимости различия этих средних значений параметра для различных уровней факторов по критерию LSD.
Результаты и обсуждение
Общая группа пациентов включала 80 детей, средний возраст которых составил 5,8±0,2 лет. Младшему ребенку была 3 года, старшему – 11 лет: 50,0% детей в возрасте от 4 до 7 лет. 41 ребенок в возрасте 3–5 лет получал курсовую дозу препарата 6 таблеток в течение 4 дней, 39 детей в возрасте 6–11 лет получали 10 таблеток Кагоцела в течение 4 дней.
Возрастная структура наблюдавшихся детей представлена на рисунке 1.
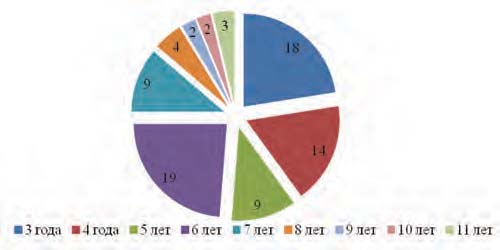
Гендерные различия пациентов были не выражены: 42 (52,5%) наблюдаемых пациента были мальчики и 38 (47,5%) – девочки.
Источник заболевания удалось установить по анамнестическим данным у 49 пациентов (61,3%). Распределение пациентов в зависимости от источника заболевания представлено на рисунке 2.
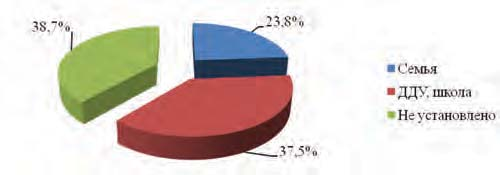
В 37,5% случаев заболевание было связано с посещением детских дошкольных учреждений (ДДУ) и школы. Источник инфицирования в семье установлен у 23,8% больных. Один ребенок (3,7%) в возрасте 3 лет и двое детей в возрасте 6 лет не посещали детских учреждений.
Этиологическая структура ОРВИ, включая грипп, у наблюдаемых больных представлена на рисунке 3.
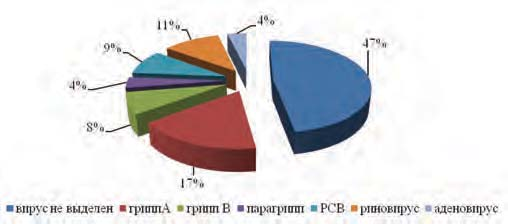
Из рисунка 3 видно, что методом ПЦР удалось выявить РНК/ДНК возбудителей у 52,5% больных (n=42). При этом 20 пациентов были больны гриппом А и В (25% от общего числа), что превышало среднегодовые значения предыдущих лет (12–16%). Сроки проведения исследования совпали с эпидемическим подъемом заболеваемости гриппом А (H1N1) pdm09 в декабре 2015 г. – феврале 2016 г. Грипп А регистрировали в 17% случаев, грипп В – в 8%. Верификация иных возбудителей острой респираторной вирусной инфекции позволила поставить уточненные диагнозы 27,5% (n=22) обследованных детей, при этом чаще выявляли риновирус и респираторно-синтициальный вирус (11% и 9% соответственно). У двух пациентов при первом обследовании были выявлены сочетанные вирусно-вирусные инфекции (аденовирусная + риновирусная и грипп А + парагрипп).
У пациентов с этиологическим подтверждением вирусной природы респираторной инфекции различались сроки госпитализации в зависимости от выявляемого патогена (рис. 4).

Как видно из рисунка 4, пациенты, у которых были выделены вирусы гриппа А и В, в 60% случев госпитализировались в стационар в первые 3 суток, в то время как дети с другими верифицированными ОРВИ преимущественно были госпитализированы на 4–5-е сутки (в 54,5% случаев). Срок поступления больных в стационар варьировал от 2 до 7 и даже 8 дней у 1 пациента с аденовирусной инфекцией. В среднем детей госпитализировали на 3–4-е сутки (3,14±1,4 суток).
У всех пациентов при поступлении в стационар отмечали наличие катарального и интоксикационного синдромов различной степени выраженности и в большинстве случаев повышение температуры тела дома и/или на момент госпитализации.
Лихорадку на момент поступления в стационар регистрировали у 72,0% пациентов. В общей группе наблюдаемых больных температура тела при госпитализации составляла в среднем 37,3±0,07°С, минимальная – 36,1°С, а максимальная – 39,0°С. Средняя температура при поступлении у девочек составила 37,1±0,1°С, что достоверно (p<0,001) меньше, чем у мальчиков – 37,5±0,1°С. В большинстве случаев лихорадка носила субфебрильный характер, причем в 36,0% случаев температура была от 37,0°С до 37,4°С, что объясняется не только разнообразием этиологических факторов (в том числе наличие РСВ-инфекции, парагриппа, риновирусной инфекции, для которых не всегда характерна фебрильная лихорадка), но и также в ряде случаев приемом жаропонижающих средств перед госпитализацией. Температуру 37,0°С и выше регистрировали в стационаре у 68 (85,0%) госпитализированных больных. Среднее значение максимальной температуры оказалось равным 38,6±0,1°С, минимальное – 37,0°С, а максимальное – 40,0°С. У 49,0% детей максимальная температура находилась в интервале 38,0–39,0°С. Средняя продолжительность лихорадки составила 2,5 дня, а максимальная – 6 дней.
У пациентов отмечались два лидирующих синдрома: интоксикационный и катаральный (рис. 5,6).


Интоксикационный синдром проявлялся слабостью (в 91,3% случаев), сонливостью (в 70,0%) и потливостью как проявлением вегетативной дисфункции на фоне интоксикационного синдрома (в 67,5%). Головная боль как характерный субъективный признак интоксикации отмечалась у трети больных (32,5%), боль в глазах – у 6,3%, что объясняется доминированием пациентов с ОРВИ негриппозной этиологии, для которых не всегда характерны выраженные проявления интоксикации, возрастом детей, 75,0% которых были дошкольного возраста и не всегда могли адекватно оценить свое состояние и изложить жалобы. У 42,5% пациентов отмечался озноб в дебюте заболевания и у 20% боль в мышцах.
Выявляли катаральные симптомы, такие как: гиперемия зева – в 100% случаев, ринит – в 97,5%, кашель – в 88,8%, заложенность носа – в 85,0%, боль в горле – в 28,8%.
Большинство симптомов протекали в слабой или средней степени выраженности с учетом их балльной характеристики. Максимальная выраженность катаральных симптомов наблюдалась в виде гиперемии зева, сопровождавшейся болями в горле (в 30,0% случаев), кашля и ринита (по 22,5%). Другие катаральные симптомы протекали в слабой или средней степени выраженности или отмечались в выраженной степени в единичных случаях. Выраженность клинических проявлений интоксикационного синдрома и лихорадки соответствуют среднетяжелым и легким формам острых респираторных вирусных инфекций. При аускультации на момент госпитализации у 19 (23,75%) пациентов выслушивались хрипы в легких, что обусловлено вирусным характером бронхита, в том числе с обструктивным синдромом.
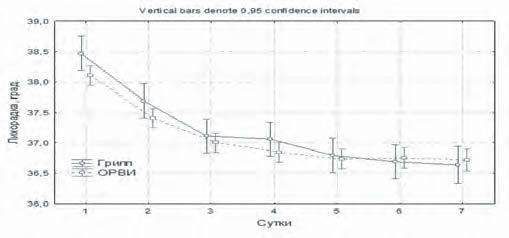
Для оценки динамики интоксикационного, катарального синдромов и лихорадки у пациентов, получающих препарат Кагоцел, использовали балльную оценку выраженности симптомов, характеризующих соответствующий синдром. При проведении многофакторного дисперсионного анализа суммарной выраженности клинических симптомов в баллах в общей группе больных и у больных гриппом была доказана большая выраженность лихорадки и синдрома интоксикации у больных гриппом, что соответствует клиническим особенностям гриппа, в том числе гриппа А (H1N1) pdm 09, который составлял 98% в структуре гриппа А в сезон 2015–2016 гг. и регистрировался у госпитализированных больных. Имело место незначительное повышение температуры на 3–4-е сутки (37,1°С) у пациентов, больных гриппом, и недостоверное превышение соответствующих показателей в общей группе больных (рис. 7).
Интоксикационный синдром был более выражен у больных гриппом с высоким достоверным различием с 1-х по 4-е сутки (р<0,001). Интоксикация быстрее купировалась в общей группе больных ОРВИ (к 5-м суткам), по сравнению с соответствующим показателем больных гриппом (к 6-м суткам) (рис. 8).
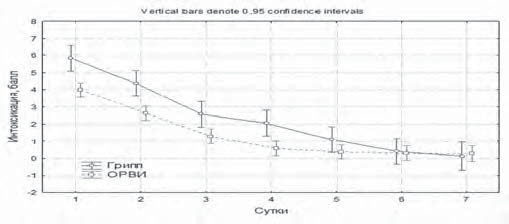
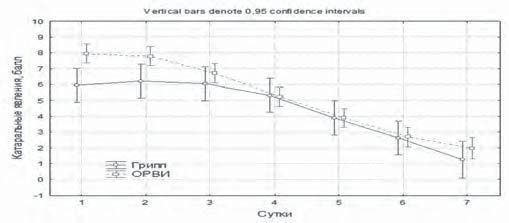
Катаральный синдром, напротив, был более выражен в общей группе больных за счет преобладания ОРВИ негриппозной этиологии. Различия выраженности катарального синдрома становились минимальными на 4–5-е сутки. К 7-м суткам в общей группе катаральные проявления сохранялись за счет более частой госпитализации детей с осложненными формами ОРВИ негриппозной этиологии, в то время как у больных гриппом катаральный синдром был полностью купирован (рис. 9).
Анализируя в динамике вирусовыделение, исследуя мазки из носовых ходов, на 5–6-е сутки от начала терапии у пациентов с подтвержденной вирусной инфекцией негативация ПЦР по окончании противовирусной терапии Кагоцелом составила 57,1% (n=24). Число пациентов, выделявших нуклеиновые кислоты респираторных вирусов до и после окончания терапии Кагоцелом, представлено на рисунке 10.
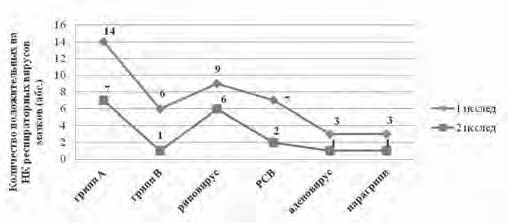
Анализ показал, что частота негативации ПЦР зависит от этиологии ОРВИ. Как видно из рисунка 10, (ссылка на рис. 10) отсутствие повторного выделения возбудителя после терапии более характерно для больных гриппом А и В (60%). У пациентов с гриппом В негативация ПЦР происходила чаще, чем у пациентов с гриппом А (83,3% против 50% соответственно), однако малое количество наблюдений не дает возможности сделать достоверные выводы. Повторное выделение РСВ зарегистрировано у 2 из 7 детей (28,6%). Существенно чаще отмечалась повторное выделение риновирусов (у 6 из 9 детей), несмотря на проведенное комплексное лечение с включением препарата Кагоцел.
В 8 случаях (10%) у детей при повторном обследовании выделялись РНК/ДНК других респираторных вирусов, не выявленных при первом обследовании. У 4 детей произошло наслоение риновирусной инфекции, причем у двоих при первом обследовании вирусы верифицированы не были, у других выделены вирусы парагриппа и РСВ. Вирус парагриппа был выделен при повторном исследовании у пациентов с ОРВИ при слабых проявлениях интоксикации, клиники ларинготрахеита, субфебрильной температуре (от 37,2°С до 37,6°С), что было расценено как подтверждение этиологии заболевания. РНК РСВ была выявлена при повторном обследовании в мазке ребенка с клиникой бронхита, по поводу которого он был госпитализирован, что также было расценено как подтверждение этиологии заболевания. В другом случае РСВ в сочетании с бокавирусом были выделены у больного с подтвержденным гриппом А, что с наибольшей вероятностью можно расценивать как суперинфекцию.
Всеми детьми или их родителями отмечалась хорошая переносимость проводимой терапии. Нежелательных явлений, связанных с проводимой комплексной терапией, включающей препарат Кагоцел, выявлено не было. Со стороны лабораторных показателей (клинический анализ крови, мочи) отмечена положительная динамика.
Заключение
Особенностью этиологической структуры острой респираторной инфекции в период с сентября 2015 г. по май 2016 г. у госпитализированных детей была большая доля гриппа А и В (25%), что отразило имевший место в Санкт-Петербурге подъем заболеваемости гриппом А (H1N1)pdm09. Использование ПЦР позволило подтвердить вирусную этиологию острых респираторных заболеваний как основного доминирующего фактора респираторной инфекции в детском возрасте. Каждый случай выявления вируса при повторном обследовании пациента должен рассматриваться в совокупности с анализом клинических проявлений, эпидемического сезона и эпидемических контактов ребенка, в том числе в стационаре, так как он может отражать как внутрибольничное инфицирование пациента, так и этиологический фактор его текущего заболевания, который не был выявлен при первом обследовании. Эффективность применения Кагоцела в структуре комплексной терапии легких и среднетяжелых форм ОРВИ и гриппа, в том числе сочетанных вирусно-вирусных респираторных заболеваний, проявлялась в купировании к 3–4-му дню лечения лихорадки в обеих сравниваемых группах. Интоксикационный синдром быстрее купировался в общей группе больных ОРВИ (к 5-м суткам), по сравнению с соответствующим показателем больных гриппом (к 6-м суткам). Катаральный синдром, превалировавший в общей группе ОРВИ, имел более длительный период нормализации: с 3-х до 7-х суток терапии. Элиминация респираторных вирусов по результатам ПЦР к 5–6-м суткам от начала терапии Кагоцелом составила 57,1%. При гриппе негативация ПЦР выявлена у 60% пациентов. Выявленные тенденции в различии частоты негативации ПЦР мазков больных ОРВИ различной этиологии, получивших курс противовирусной терапии Кагоцелом, требуют проведения дальнейших исследований для получения более полных данных на большей выборке пациентов. Нежелательных проявлений у больных на фоне проводимой терапии не отмечалось, что подтверждает безопасность использования препарата Кагоцел.
Литература
- Rick D. Kellerman, Edward T. Bope. Coon s Current Therapy. 2018. Chapter 11, Robert C.
- Welliver. Viral respiratory infections; p. 849-50.
- Ровный, В.Б. Клинико-эпидемиологическая характеристик респираторно-синцитиальной вирусной инфекции у больных с поражением нижних отделов респираторного тракта: автореф. дис. …к.м.н. / В.Б. Ровный. – СПб: ВМедА, 2014. – С. 16.
- Евдокимов, К.В. Респираторно-синтициальная инфекция у детей раннего возраста / К.В. Евдокимов [и др.] // Медицинский совет. – 2017. – № 4. – С. 7–10.
- Бабаченко, И.В. Подходы к терапии ОРВИ у детей в стационаре и поликлинике / И.В. Бабаченко, Е.В. Шарипова, Т.Л. Беликова // Медицинский совет. – 2017. – № 1. – С. 94–99.
- Харламова, Ф.С. Метапневмовирусная и бокавирусная респираторные инфекции в структуре ОРВИ у детей / Ф.С. Харламова [и др.] // Детские инфекции. – 2015. – № 2. – С. 5–11.
- Shapiro D, Bodinayake CK, Nagahawatte A, Devasiri V, Kurukulasooriya R, Hsiang J, Nicholson B, DeSilva AD, Qstbye T, Reller ME, Woods CW, Tillekeratne LG. Burden and Seasonality of Viral Acute Respiratory Tract Infections among Outpatients in Southern Sri Lanka. Am. J. Trop. Med. Hyg. – July 1, 2017; 97 (1); 88-96.
- Харламова, Ф.С. Возможности применения противовирусного препарата Кагоцел для профилактики и лечения гриппа и других острых респираторных инфекций у часто болеющих детей младшего возраста / Ф.С. Харламова [и др.] // Эффективная фармакотерапия. – 2012. – № 1. – С. 26–34.
- Сайиткулов, А.М. Биологическая характеристика новых индукторов интерферона, созданных на основе госсипола / А.М. Сайиткулов [и др.] // Вопросы вирусологии. – 1984. – № 6. – С. 749–751.
- Вартанян, Р.В. Оценка терапевтической эффективности препарата Кагоцел® у детей младшего и дошкольного возраста с острыми респираторными вирусными инфекциями / Р.В. Вартанян, Э.М. Сергеева, С.Г. Чешик // Детские инфекции. – 2011. – № 1. – С. 36–41.
- Харламова, Ф.С. Клиническая эффективность препарата Кагоцел® при гриппе и ОРВИ у детей с 2 до 6 лет / Ф.С. Харламова [и др.] // Детские инфекции. – 2010. – № 4. – С. 34–41.
- Ёлкина, Т.Н. Комплексная терапия острых респираторных заболеваний у детей дошкольного возраста на педиатрическом участке / Т.Н. Ёлкина [и др.] // Лечащий врач. – 2014. – № 2. – С. 1–4.
References
- Rick D. Kellerman, Edward T. Bope. Coon s Current Therapy. 2018. Chapter 11, Robert C.
- Welliver. Viral respiratory infections; p. 849-50.
- Rovnyj V.B. Kliniko-jepidemiologicheskaja harakteristik respiratorno-sincitial’noj virusnoj infekcii u bol’nyh s porazheniem nizhnih otdelov respiratornogo trakta [Clinico-epidemiological characteristics of respiratory syncytial viral infection in patients with lower respiratory tract disease] [dissertation]. Saint-Petersburg (Russia): VMedA; 2014. 16 p (in Russian).
- Evdokimov K.V., Rovnyj V.B., Babachenko I.V., Sharipova E.V. Medicinskij sovet. 2017; 4: 7-10 (in Russian).
- Babachenko I.V., Sharipova E.V., Belikova T.L. Medicinskij sovet. 2017; 1: 94-9 (in Russian).
- Harlamova F.S., Kladova O.V., Uchajkin V.F., Cheshik S.G., Vartanjan R.V., Jablonskaja K.P. Detskie infekcii. 2015; 2: 5-11 (in Russian).
- Shapiro D, Bodinayake CK, Nagahawatte A, Devasiri V, Kurukulasooriya R, Hsiang J, Nicholson B, DeSilva AD, Qstbye T, Reller ME, Woods CW, Tillekeratne LG. Burden and Seasonality of Viral Acute Respiratory Tract Infections among Outpatients in Southern Sri Lanka. Am. J. Trop. Med. Hyg. – July 1, 2017; 97 (1); 88-96.
- Harlamova F.S., Kladova O.V., Uchajkin V.F., Sergeeva Je.M., Nesterenko V.G., Legkova T.P. [et al.]. Jeffektivnaja farmakoterapija. 2012; 1: 26-34 (in Russian).
- Sajitkulov A.M., Tazulahova Je.B., Sarymsakov A.A [etal.]. Voprosy virusologii. 1984; 6: 749-51 (in Russian).
- Vartanjan R.V., Sergeeva Je.M., Cheshik S.G. Detskie infekcii. 2011; 1: 36-41 (in Russian).
- Harlamova F.S., Kladova O.V., Sergeeva Je.M., Shherbakova A.A., Jablonskaja K.P., Legkova T.P., Fel’dfiks L.I., Rogova L.A., Samson O.S., Uchajkin V.F. Detskie infekcii. 2010; 4: 34-41 (in Russian).
- Jolkina T. N., Pirozhkova N.I., Gribanova O.A., Lihanova M.G. Lechashhij vrach. 2014; 2: 1-4 (in Russian).
Авторский коллектив:
Шарипова Елена Витальевна – научный сотрудник отдела респираторных (капельных) инфекций Детского научно-клинического центра инфекционных болезней, к.м.н.; тел.: 8(812)234-29-87, +7-921-747-57-18, e-mail: lenowna2000@yandex.ru
Бабаченко Ирина Владимировна – ведущий научный сотрудник, руководитель отдела респираторных (капельных) инфекций Детского научно-клинического центра инфекционных болезней; профессор кафедры инфекционных болезней у детей Санкт-Петербургского государственного педиатрического медицинского университета, д.м.н., профессор; тел.: 8(812)234-29-87, +7-921-579-96-51, e-mail: babachenko-doc@mail.ru
Левина Анастасия Сергеевна – врач Детского научно-клинического центра инфекционных болезней; ассистент кафедры инфекционных болезней у детей Санкт-Петербургского государственного педиатрического медицинского университета, к.м.н.; тел.: 8(812)234-29-87, +7-921- 349-43-27, e-mail: rossii@mail.ru
Григорьев Степан Григорьевич – старший научный сотрудник научно-организационного отдела Детского научно-клинического центра инфекционных болезней; старший научный сотрудник научно-исследовательского центра Военно-медицинской академии им. С.М. Кирова, д.м.н., профессор; тел.: 8(812)234-29-87, +7-904-644-14-00, e-mail: gsg_rj@mail.ru
