Противовирусная активность Кагоцела на модели экспериментальной летальной гриппозной инфекции
Antiviral Activity of Kagocel®on the Model of Experimental Lethal Influenza Infection
* V. V. ZARUBAEV, A. V. GARSHININA, A. V. SLITA, S. V. BELYAEVSKAYA, I. N. LAVRENTIEVA Saint Petersburg Pasteur Institute, St. Petersburg
* © Коллектив авторов, 2020, Адрес для корреспонденции: 197001 Санкт-Петербург, ул. Мира, 14. Санкт-Петербургский научно-исследовательский институт им. Пастера
Несмотря на очевидные успехи в области вакцинации и терапии, грипп остается плохо контролируемой инфекцией с высокой заболеваемостью и смертностью. В настоящем исследовании изучена противовирусная активность индуктора интерферона Кагоцела на модели летальной гриппозной пневмонии у мышей. Показано, что лечебно-профилактическое применение Кагоцела приводит к дозозависимому снижению специфической смертности и подавлению репродукции вируса в ткани легких. Эффект Кагоцела был статистически идентичен эффекту препарата сравнения — Арбидолу.
Ключевые слова: экспериментальная гриппозная инфекция, противовирусная активность, Кагоцел.
Despite the obvious advances in vaccination and therapy, influenza remains a poorly controlled infection with high morbidity andmortality. This study examined the antiviral activity of an interferon inducer Kagocel on a mouse model of lethal influenza pneumonia. It has been shown that the therapeutic and prophylactic use of Kagocel leads to a dose-dependent decrease in specific mortality and suppression of virus reproduction in lung tissue. The effect of Kagocel was statistically identical to the effect of the reference drug — Arbidol (umifenovir)
Keywords: experimental lethal influenza infection, antiviral activity, Kagocel.
Введение
Грипп представляет собой наиболее распространенную и опасную инфекцию из всех респираторных вирусных патологий человека. Ежегодно эпидемии гриппа приводят к большому числу заболевших, среди которых наибольшей опасности подвергаются пациенты из групп риска: дети, пожилые, беременные женщины и лица с иммунодефицитами любой этиологии [1]. Симптомы гриппа включают высокую температуру и лихорадку, головную боль, интоксикационный синдром. В случаях тяжелого гриппа отмечается присоединение вторичной бактериальной инфекции, развивается цитокиновый шторм, многочисленные внутренние геморрагии, включая геморрагический отек легких, отек мозга и зачастую наблюдается летальный исход [2]. Вирус гриппа принадлежит к семейству Orthomyxoviridae. Вирионы представляют собой сферические или филаментозные частицы диаметром 80–100 нм. Геном вируса представлен сегментированной одноцепочечной РНК негативной полярности. После проникновения в клетку и «раздевания вириона сегменты генома попадают в цитоплазму, где вирусная полимераза осуществляет транскрипцию и репликацию вРНК. В результате образуются молекулы вирус-специфической матричной РНК (мРНК) и комплементарной РНК (кРНК), соответственно. На матрице кРНК впоследствии синтезируется цепь вРНК, входящая затем в состав вирионов потомства. мРНК транслируется при помощи клеточных механизмов с образованием структурных и неструктурных белков, первые из которых образуют вирионы потомства, а последние играют важные регуляторные функции в ходе жизненного цикла вируса. Основным способом контроля гриппозной инфекции является вакцинация. Тем не менее, особенности генома и механизмов репликации вируса гриппа дают возможность быстрого накопления мутаций. Это приводит к селекции вариантов, не соответствующих антителам, выработанным на исходный вирус после вакцинации. Такая способность приводит к ускользанию от специфического иммунного ответа, антигенному дрейфу вируса, и объясняет, почему штаммовый состав вакцин требует ежегодного обновления [3]. Кроме того, существуют группы лиц с противопоказаниями к вакцинации, с недостаточно эффективным иммунным ответом. В этих случаях химиотерапия становится единственным способом как предотвращения заболевания конкретного человека, так и распространения гриппа в популяции в целом. На сегодняшний день для терапии гриппа используются препараты трех групп. Это препараты адамантанового ряда — ремантадин (a-метил-1-адамантил-метиламина гидрохлорид) и амантадин (1-аминоадамантан) [4]. Другой мишенью для лекарственного вмешательства является вирусная нейраминидаза — фермент, необходимый для нормального почкования вирусных частиц и проявления инфекционных свойств вируса гриппа, против которой эффективны нейраминидазные ингибиторы — занамивир (Реленза®), осельтамивир (Тамифлю®) [5], перамивир [6] и ланинамивир (Авиган®) [7]. В 2018 г. FDA одобрила новый препарат — балоксавир марбоксил (Ксофлюза®), ингибирующий полимеразный комплекс вируса гриппа [8]. В России и ряде других стран используется блокатор вирусного гемагглютинина Арбидол®[9]. В отношении группы производных адамантана можно отметить сравнительно высокую токсичность, узкий спектр действия (препараты активны против гриппа А, но не против гриппа В) и быстрое формирование устойчивости вируса к препаратам. Для ингибиторов нейраминидазы характерны формирование резистентности вирусов и высокая стоимость синтеза, что делает эти препараты менее доступными для широкого использования. То же можно сказать и о балоксавире, устойчивость вируса к которому уже отмечена у детей [10]. Формирование резистентности вируса особенно быстро происходит на фоне профилактического или длительного терапевтического приема химиопрепаратов лицами с ослабленной иммунной системой [11]. В этой связи для эффективной профилактики и лечения гриппа целесообразно применять препараты непрямого действия, действующие опосредованно через систему врожденного иммунитета. Это создает неспецифический барьер для вируса на самых ранних стадиях инфекции, что позволяет предотвратить заболевание или облегчить его течение и сократить срок, а также избегнуть осложнений. Одним из подобных препаратов, широко применяемых в России и странах СНГ, является препарат Кагоцел® — сополимер природного полифенола госсипола с карбоксиметилцеллюлозой, индуцирующий выработку интерферонов [12]. Цель исследования — оценка протективной активности препарата Кагоцел на модели экспериментальной летальной гриппозной инфекции у лабораторных животных.
Материал и методы
Вирусы и клетки. В работе был использован вирус гриппа A/California/07/09 (H1N1)pdm09 из коллекции вирусных штаммов НИИЭМ им. Пастера. Вирус накапливали в аллантоисной полости 10-12-дневных куриных эмбрионов (птицефабрика «Скворицы» Ломоносовского р-на Ленинградской области) в течение 48 ч при 36°С. Титрование инфекционной активности вируса проводили в культуре клеток MDCK (ATCC CCL-34).
Животные. Белых беспородных мышей (самок) массой 16–18 г (возраст — 5–6 нед.) получали из питомника «Рапполово» (Ленинградская обл.). Субстанцию Кагоцела вводили перорально в объёме 0,2 мл один раз в день в дозе 24, 48 или 60 мг/кг/сут. в следующем режиме: за 24 ч и за 1 ч до инфицирования вирусом, через 1, 2, 3, 4 и 5 дней после заражения. В качестве препаратов сравнения использовали Арбидол® и осельтамивира фосфат (Тамифлю®). Арбидол® использовали в дозировке 130 мг/кг/сут. по той же схеме, что и Кагоцел, Тамифлю вводили перорально в дозе 20 мг/кг/сут. один раз в день в течение 5 сут., начиная со дня инфицирования.
В каждую группу опыта включали 30 животных. На 3-и сутки после инфицирования по 10 животных из каждой группы умерщвляли, изолировали лёгкие и использовали для определения инфекционной активности вируса в ткани. Наблюдение за оставшимися животными осуществляли в течение 14 дней после инфицирования. Ежедневно фиксировали смертность животных в контрольных и опытных группах. На основании полученных данных в каждой группе рассчитывали процент смертности (отношение числа павших животных к общему числу зараженных животных в группе) и индекс защиты (отношение разницы процентов смертности в контрольной и опытной группах к проценту смертности в контрольной группе).
Титрование вируса. Для определения инфекционного титра вируса лёгкие животных гомогенизировали в десятикратном объёме стерильного физиологического фосфатного буфера и готовили из гомогенатов серию десятикратных разведений (10-1–10-6) на том же буфере. При определении титра вируса использовали культуру клеток MDCK, выращенных на 96-луночных панелях на среде МЕМ. Клетки заражали серийными десятикратными разведениями гомогенатов от 10-1 до 10-7 и инкубировали в термостате в течение 96 ч. По окончании срока инкубации культуральную жидкость (0,1 мл) переносили в лунки планшетов с круглым дном и добавляли равный объём 1% куриных эритроцитов. Планшеты инкубировали при комнатной температуре в течение часа, после чего учитывали результаты гемагглютинации. На основании полученных данных при помощи метода Рида и Менча рассчитывали титр вируса, который выражали в десятичных логарифмах 50% тканевой цитотоксической инфекционной дозы (lg TCID50). О противовирусной активности соединений судили по снижению инфекционного титра вируса.
Анализ данных. Статистический анализ результатов проводили при помощи программы GraphPad Prism 2.0. Анализ выживаемости проводили путем построения кривых выживаемости с применением метода Каплана–Майера. Статистически значимые различия между группами определяли лог-ранговым тестом (Мантел–Кокс) с последующим попарным сравнением методом Гехана–Бреслоу–Вилкоксона. Сравнение показателей содержания титра вируса в легких осуществляли с использованием ANOVA и последующим попарным сравнением с применением критерия Тьюки. Статистически значимыми считали различия при p<0,05.
Результаты и обсуждение
Клинические признаки заболевания у инфицированных мышей были типичными для гриппозной инфекции. Они включали: затруднённое дыхание, атаксию, тремор, а также снижение потребления корма и воды. Неспецифической смертности в контрольной группе интактных животных отмечено не было. Полученные данные по динамике смертности животных в контрольных и опытных группах суммированы в табл. 1 и представлены на рисунке 1.
| Препарат | Смертность, % | Индекс защиты, % | P |
|---|---|---|---|
| Кагоцел 24 мг/кг/сут. | 15/20 (75%) | 11,8 | 0,1620 |
| Кагоцел 36 мг/кг/сут. | 12/20 (55%) | 35,3 | 0,0470 |
| Кагоцел 60 мг/кг/сут. | 9/20 (45%) | 47,1 | 0,0007 |
| Арбидол 130 мг/кг/сут. | 8/20 (40%) | 52,9 | 0,0004 |
| Тамифлю 20 мг/кг/сут. | 1/20 (5%) | 94,1 | <0,0001 |
| Плацебо | 17/20 (85%) | - | 1,0000 |
Примечание. * — различия с контрольной группой достоверны при уровне доверительной вероятности p<0,05.
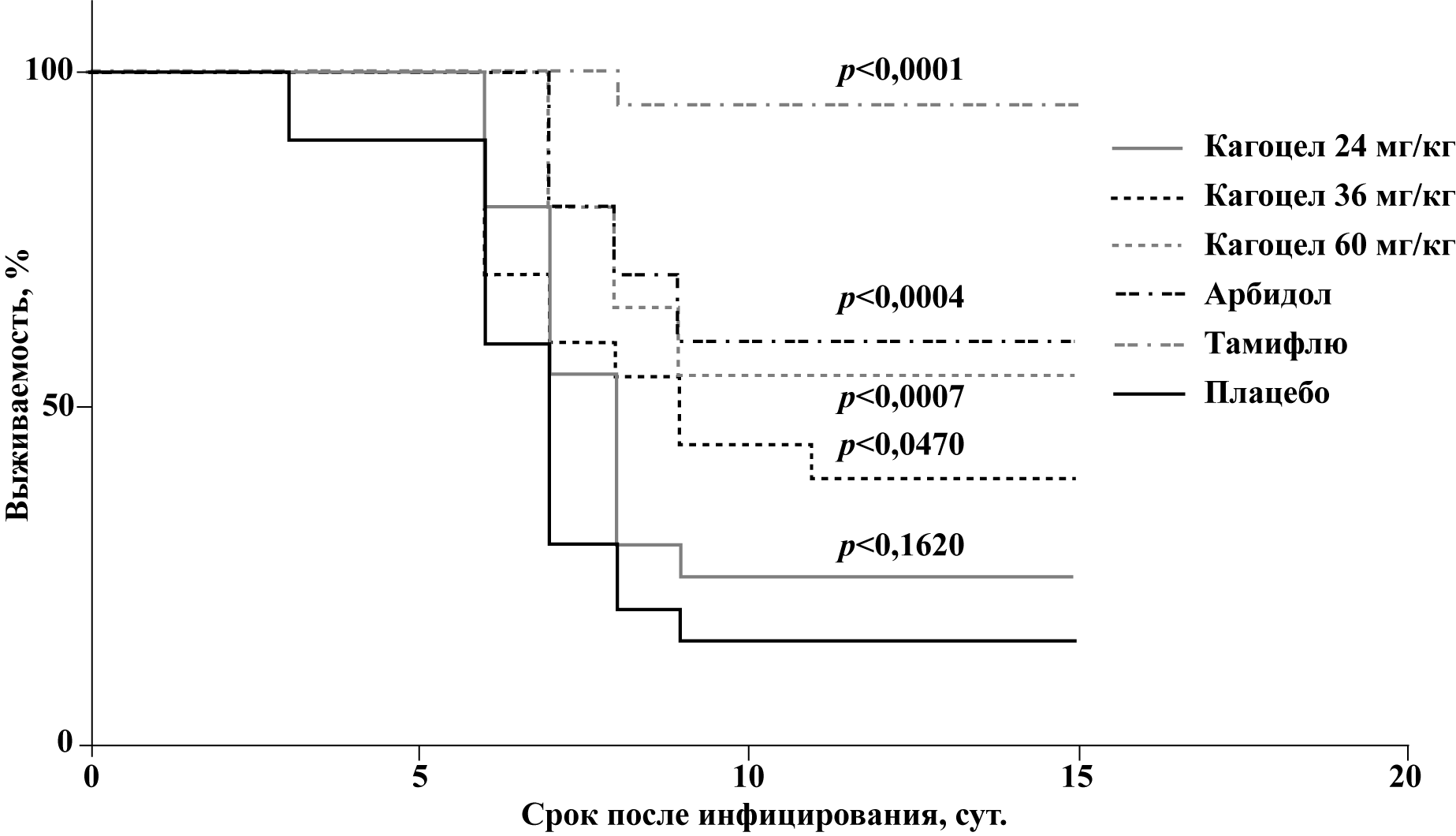
Как видно из представленных данных, заражение мышей вирусом гриппа приводило к специфической смертности животных, начиная с 3-х суток после инфицирования. К 15-м суткам эксперимента гибель животных в контрольной группе (плацебо) составила 85%. Применение референс-препарата Тамифлю в дозе 20 мг/кг/сут приводило к снижению смертности до 5% (индекс защиты 94,1%, p<0,0001), Арбидола в дозе 130 мг/кг/сут. — до 40% (ИЗ=52,9%, p=0,0004 ). На фоне введения Кагоцела во всех изученных дозах наблюдалось статистически значимое увеличение индекса защиты по сравнению с группой плацебо. Так, индекс зашиты при введении Кагоцела в дозе 60 мг/кг/сут. составил 47,1% (p=0,0007), при дозе 36 мг/кг/сут. — 35,3% (p=0,0470). В дозировке 24 мг/кг/сут. препарат также проявлял протективную активность, однако отличия от группы плацебо при этом не достигали статистически достоверных величин. Полученные данные были подтверждены при помощи изучения титров вируса в ткани лёгких животных. Результаты исследования представлены в табл. 2.
| Препарат | Титр вируса в ткани лёгких, lg TCID50/20 мг (M±SE, n=10) |
|---|---|
| Кагоцел 24 мг/кг/сут. | 5,6±0,2 (p=0,0426)* |
| Кагоцел 36 мг/кг/сут. | 5,4±0,2 (p=0,0223)* |
| Кагоцел 60 мг/кг/сут. | 5,3±0,3 (p=0,0276)* |
| Арбидол 130 мг/кг/сут. | 5,1±0,3 (p=0,0036)* |
| Тамифлю 20 мг/кг/сут. | 3,7±0,7 (p=0,0051)* |
| Плацебо | 6,1±0,1 |
Примечание. * — различия с контрольной группой достоверны при уровне доверительной вероятности p<0,05.
Как следует из представленных результатов, использованный вирус гриппа эффективно размножался в лёгких лабораторных животных, достигая через 3 сут. после инфицирования инфекционного титра 6,1 lg TCID50/20 мг. Использование препарата сравнения Тамифлю приводило к снижению инфекционной активности вируса на 2,4 порядка, что соответствует ранее полученным данным о чувствительности использованного вируса к осельтамивиру.
Применение Арбидола также приводило к достоверному подавлению вирусной репродукции на 1,0 lg TCID50. Кагоцел во всех исследованных дозах (60, 36 и 24 мг/кг/сут.), как и препараты сравнения, статистически достоверно снижал активность вируса на 0,8; 0,7 и 0,5 порядка, соответственно.
В настоящем исследовании показано, что лечебно-профилактическое применение Кагоцела на модели летальной гриппозной пневмонии у мышей приводит к дозозависимому снижению специфической смертности и подавлению репродукции вируса в ткани лёгких. При этом эффект Кагоцела был статистически идентичен эффекту препарата сравнения — Арбидолу.
Основной механизм действия Кагоцела, как полимерного лекарства, реализуется в значительной мере за счёт воздействия на иммунные механизмы слизистой оболочки (СО) желудочно-кишечного тракта (ЖКТ). Кагоцел взаимодействует с иммуноцитами СО ЖКТ, в которой сосредоточено около 70% иммунокомпетентных клеток тела человека.
Противовирусное действие препарата Кагоцел не является прямым, так как точкой приложения препарата не являются белки вирусов. Противовирусное действие обусловлено способностью стимулировать и восстанавливать синтез собственных ИФН в условиях иммуносупрессивного действия различных вирусов. Эта особенность обеспечивает универсальность действия — способность подавлять развитие разных вирусов как возбудителей гриппа и острых респираторных вирусных инфекций (ОРВИ) другой этиологии, так и вирусов герпеса[13].
Это приводит к развитию неспецифического противовирусного ответа, препятствующего инфицированию и ранним стадиям распространения вируса в организме. Отсутствие этиологической специфичности такого ответа обусловливает активность Кагоцела в отношении многих возбудителей респираторных вирусных инфекций. Это отличает его от противовирусных препаратов прямого механизма действия, таких как Тамифлю, Реленза и др. Универсальность реакций врождённого иммунитета исключает также выработку резистентности вируса к препарату, поскольку его действие направлено не на вирусную мишень, а на стимуляцию неспецифических иммунных реакций организма.
Таким образом, в данном исследовании была показана высокая эффективность Кагоцела на экспериментальной модели летальной пневмонии у мышей, вызванной гриппозной вирусной инфекцией при использовании по лечебно-профилактической схеме. Полученные данные согласуются с ранее полученными результатами клинических исследований об эффективности применения Кагоцела как при профилактическом курсе, так и для лечения респираторных инфекций[14-25].
Следует отметить, что ранее полученные данные о повышении эффективности Кагоцела в комбинации с этиотропными средствами терапии гриппа в клинике позволяют прогнозировать подобные эффекты в исследованиях на животных[26].
Литература
- Khanna M., Kumar P., Choudhary K., Kumar B., Vijayan V. K. Emerging influenza virus: a global threat. J Biosci 2008; 33: 475–482.
- Patel K. K., Patel A. K., Shah S., Ranjan R., Shah S.V. Adult patient with novel H1N1 infection presented with encephalitis, rhabdomyolysis, pneumonia and polyneuropathy. J Glob Infect Dis 2012; 4, 178–181.
- Osterhaus A., Fouchier R., Rimmelzwaan G. Towards universal influenza vaccines? Philos Trans R Soc Lond B Biol Sci 2011; 366 (1579): 2766–2773.
- Scholtissek C., Quack G., Klenk H.D., Webster R.G. How to overcome resistance of influenza A viruses against adamantane derivatives. Antiviral Res 1998; 37 (2): 83–95.
- Colman P.M. A novel approach to antiviral therapy for influenza. J Antimicrob Chemother 1999; 44: Suppl B: 17–22.
- Mancuso C.E., Gabay M.P., Steinke L.M., Vanosdol S.J. Peramivir: an intravenous neuraminidase inhibitor for the treatment of 2009 H1N1 influenza. Ann Pharmacother 2010; 44 (7–8): 1240–1249.
- McKimm-Breschkin J.L. Influenza neuraminidase inhibitors: antiviral action and mechanisms of resistance. Influenza Other Respir Viruses 2013; 7: Suppl 1: 25–36.
- Heo Y.A. Baloxavir: First Global Approval. Drugs 2018; 78 (6): 693–697.
- Blaising J., Polyak S.J., Pecheur E.I. Arbidol as a broad-spectrum antiviral: an update. Antiviral Res 2014; l:107: 84–94.
- Imai M., Yamashita M., Sakai-Tagawa Y., Iwatsuki-Horimoto K., Kiso M., Murakami J., Yasuhara A., Takada K., Ito M., Nakajima N., Takahashi K., Lopes T.J.S., Dutta J., Khan Z., Kriti D., van Bakel H., Tokita A., Hagiwara H., Izumida N., Kuroki H., Nishino T., Wada N., Koga M., Adachi E., Jubishi D., Hasegawa H., Kawaoka Y. Influenza A variants with reduced susceptibility to baloxavir isolated from Japanese patients are fit and transmit through respiratory droplets. Nat Microbiol 2019. doi: 10.1038/s41564-019-0609-0
- Kossyvakis A., Mentis A.A., Tryfinopoulou K., Pogka V., Kalliaropoulos A., Antalis E., Lytras T., Meijer A., Tsiodras S., Karakitsos P., Mentis A.F. Antiviral susceptibility profile of influenza A viruses; keep an eye on immunocompromised patients under prolonged treatment. Eur J Clin Microbiol Infect Dis 2017; 36 (2): 361–371.
- Кондюрина Е.Г., Заплатников А.Л., Елкина Т.Н., Бурцева Е.И., Грибанова О.А., Пирожкова Н.И., Мингалимова Г.А., Тюленева И.О., Трушакова С.В., Мукашева Е.А. Многоплановая оценка схем терапии острых респираторных инфекций в условиях рутинной педиатрической практики. Антибиотики и химиотер. — 2016. — Т. 61. — № 5–6. — С. 8–20. / Kondjyurina E.G., Zaplatnikov A.L., Elkina T.N., Burtseva E.I., Gribanova O.A., Pirozhkova N.I., Mingalimova G.A., Tjyuleneva I.O., Trushakova S.V., Mukasheva E.A. Mnogoplanovaya otsenka skhem terapii ostrykh respiratornykh infektsij v usloviyakh rutinnoj pediatricheskoj praktiki. Antibiotiki i khimioter 2016; 61: 5–6: 8–20. [in Russian]
- Сологуб Т.В., Цветков В.В. Кагоцел в терапии гриппа и острых респираторных вирусных инфекций: анализ и систематизация данных по результатам доклинических и клинических исследований. Терапевтический архив. — 2017. — Т. 89. — № 8. — С. 113–119. / Sologub T.V., Tsvetkov V.V. Kagotsel v terapii grippa i ostrykh respiratornykh virusnykh infektsij: analiz i sistematizatsiya dannykh po rezul'tatam doklinicheskikh i klinicheskikh issledovanij. Terapevticheskij arkhiv 2017; 89 (8): 113–119. [in Russian]
- Тихонова Е.П., Кузьмина Т.Ю., Калинина Ю.С. Оценка профилактического эффекта индуктора поздних интерферонов в отношении острых респираторных вирусных инфекций у лиц молодого возраста. Лечащий врач. — 2018. — № 10. — С. 28–31. / Tikhonova E.P., Kuz'mina T.Jyu., Kalinina Jyu.S. Otsenka profilakticheskogo effekta induktora pozdnikh interferonov v otnoshenii ostrykh respiratornykh virusnykh infektsij u lits molodogo vozrasta. Lechashchij vrach 2018; 10: 28–31. [in Russian]
- Ситников И.Г., Фазылов В.Х., Силина Е.В., Шевченко С.Б., Малышев Н.А., Еганян Г.А., Гроппа Л.Г. Корсантия Б.М. Влияние сроков начала терапии острой респираторной вирусной инфекции и гриппа на динамику клинических симптомов и исходы заболевания (результаты когортного международного наблюдательного исследования FLU-EE). Клиническая медицина. — 2017. — № 96 (7). — С. 634–641. / Sitnikov I.G., Fazylov V.Kh., Silina E.V., Shevchenko S.B., Malyshev N.A., Eganyan G.A., Groppa L.G. Korsantiya B.M. Vliyanie srokov nachala terapii ostroj respiratornoj virusnoj infektsii i grippa na dinamiku klinicheskikh simptomov i iskhody zabolevaniya (rezul'taty kogortnogo mezhdunarodnogo nabljyudatel'nogo issledovaniya FLU-EE). Klinicheskaya meditsina 2017; 96 (7): 634–641. [in Russian]
- Малышев Н.А., Львов Н.И., Мальцев О.В. Оценка эффективности и безопасности комплексной терапии острых респираторных заболеваний аденовирусной этиологии у молодых лиц. Лечащий Врач. — 2018. — № 5. — С. 89–94. / Malyshev N.A., L'vov N.I., Mal'tsev O.V Otsenka effektivnosti i bezopasnosti kompleksnoj terapii ostrykh respiratornykh zabolevanij adenovirusnoj etiologii u molodykh lits. Lechashchij Vrach 2018; 5: 89–94. [in Russian]
- Петров В.А., Родионова Н.В., Малюков А.В. и др. Клинико-эпидемиологическая эффективность индуктора поздних интерферонов при профилактике ОРВИ и гриппа в предэпидемический период 2017–2018 года. Лечащий Врач. — 2018. — № 6. — С. 3–7. / Petrov V.A., Rodionova N.V., Maljyukov A.V. i dr. Kliniko-epidemiologicheskaya effektivnost' induktora pozdnikh interferonov pri profilaktike ORVI i grippa v predepidemicheskij period 2017–2018 goda. Lechashchij Vrach 2018; 6: 3–7. [in Russian]
- Popov A.F., Shchelkanov M.Yu., Dmitrenko K.A., Simakova A.I. Combined therapy of influenza with antiviral drugs with a different mechanism of action in comparison with monotherapy. J Pharm Scienc Res 2018; 10 (2): 357–360.
- Malyshev N.A., Lvov N.I., Maltsev O.V. Evaluation of the efficacy and safety of complex therapy of acute respiratory diseases of adenoviral etiology in young people. World J Pharm Res 2018; 7: 16: 1724–1733.
- Попов А.Ф., Симакова А.И., Дмитренко К.А., Щелканов М.Ю. Повышение противогриппозной эффективности Осельтамивира (Тамифлю®) и Умифеновира (Арбидола) путём сочетанного применения с Кагоцелом. Антибиотики и химиотер. — 2017. — Т. 62. — № 1–2. — С. 25–29. / Popov A.F., Simakova A.I., Dmitrenko K.A., Shchelkanov M.Jyu. Povyshenie protivogrippoznoj effektivnosti Osel'tamivira (Tamifljyu®) i Umifenovira (Arbidola) putem sochetannogo primeneniya s Kagotselom. Antibiotiki i khimioter 2017; 62: 1–2: 25–29. [in Russian]
- Шит С.М. Профилактика ОРВИ и гриппа индукторами интерферона у детей с аллергическими заболеваниями. Conferintёa sёtiintёifica CENTRUL MEDICAL «GALAXIA». 2018. — № 2 (67). — С. 24–28. / Shit. S.M. Profilaktika ORVI i grippa induktorami interferona u detej s allergicheskimi zabolevaniyami. Conferintёa sёtiintёifica CENTRUL MEDICAL «GALAXIA» 2018; 2 (67): 24–28. [in Russian]
- Зайцев А. А., Будорагин И. Е., Исаева Е. И. и др. Фармакотерапия острого бронхита: расставляем приоритеты. Антибиотики и химио-тер. — 2019. — Т. 64. — № 1–2. — С. 44–49. / Zajtsev A. A., Budoragin I. E., Isaeva E. I. i dr. Farmakoterapiya ostrogo bronkhita: rasstavlyaem prioritety. Antibiotiki i khimioter 2019; 64: 1–2: 44–49. [in Russian]
- Попов А. Ф., Симакова А. И., Комарова И. А. Эффективность применения противовирусного препарата Кагоцел® в комплексном лечении вирусно-бактериальных пневмоний в условиях стационара. Медицинский алфавит. 2009. — Т. 9. — № 1. — С. 23–26. / Popov F., Simakova A. I., Komarova I. A. Effektivnost' primeneniya protivovirusnogo preparata Kagotsel® v kompleksnom lechenii virusnobakterial'nykh pnevmonij v usloviyakh statsionara. Meditsinskij alfavit 2009; 9: 1: 23–26. [in Russian]
- Силина Е.В., Ситников И.Г., Фазылов В.Х., Еганян Г.А. Лечение острых респираторных вирусных инфекций и гриппа у пациентов с артериальной гипертензией. Терапевтический архив. — 2019. — № 9. — С. 53–61. / Silina E.V., Sitnikov I.G., Fazylov V.Kh., Eganyan G.A. Lechenie ostrykh respiratornykh virusnykh infektsij i grippa u patsientov s arterial'noj gipertenziej. Terapevticheskij arkhiv 2019; 9: 53–61. [in Russian]
- Ситников И.Г, Фазылов В.Х., Силина Е.В. Лечение гриппа и других ОРВИ у больных сахарным диабетом. Терапевтический архив. — 2019. — № 10. — С. 39–47. / Sitnikov I.G, Fazylov V.Kh., Silina E.V. Lechenie grippa i drugikh ORVI u bol'nykh sakharnym diabetom. Terapevticheskij arkhiv 2019; 10: 39–47. [in Russian]
- Попов А.Ф., Симакова А.И., Дмитренко К.А., Щелканов М.Ю. Повышение противогриппозной эффективности Осельтамивира (Тамифлю®) и Умифеновира (Арбидола) путём сочетанного применения с Кагоцелом. Антибиотики и химиотер. 2017. — Т. 62. — № 1–2. — С. 25–29. / Popov A.F., Simakova A.I., Dmitrenko K.A., Shchelkanov M.Jyu. Povyshenie protivogrippoznoj effektivnosti Osel'tamivira (Tamifljyu®) i Umifenovira (Arbidola) putem sochetannogo primeneniya s Kagotselom. Antibiotiki i khimioter 2017; 62: 1–2: 25–29. [in Russian]
Сведения об авторах
Зарубаев Владимир Викторович — д. б. н., ст. н. с. лаб. экспериментальной вирусологии ФБУН НИИ эпидемиологии и микробиологии им. Пастера, Санкт-Петербург
Гаршинина Аныелика Валерьевна — н. с. лаб. экспериментальной вирусологии ФБУН НИИ эпидемиологии и микробиологии им. Пастера, Санкт-Петербург
Слита Александр Валентинович — к. б. н., ст. н. с. лаб. экспериментальной вирусологии ФБУН НИИ эпидемиологии и микробиологии им. Пастера
Беляевская Светлана Валентиновна — н. с. лаб. экспериментальной вирусологии ФБУН НИИ эпидемиологии и микробиологии им. Пастера, Санкт-Петербург
Лаврентьева Ирина Николаевна — д. м. н., зав. лабораторией экспериментальной вирусологии ФБУН НИИ эпидемиологии и микробиологии им. Пастера, Санкт-Петербург
