ОЦЕНКА ВОЗМОЖНОСТИ ВЫСВОБОЖДЕНИЯ СВОБОДНОГО ГОССИПОЛА ИЗ ПРЕПАРАТА «КАГОЦЕЛ» ПОД ВОЗДЕЙСТВИЕМ ИМИТАТОРОВ ПИЩЕВАРИТЕЛЬНЫХ СОКОВ ЧЕЛОВЕКА
Введение. Лекарственный препарат «Кагоцел» (таблетки 12 мг) создан на основе полимера окисленной целлюлозы с привитыми химически модифицированными молекулами природного полифенола – госсипола. В связанном состоянии этот природный полифенол с высокой биологической активностью утрачивает свою токсичность, при этом сохраняя полезные фармакологические свойства. При производстве субстанции «Кагоцел» обеспечивается тщательное удаление и контроль остаточного количества не связавшихся остатков свободного госсипола. Отсутствие токсических эффектов препарата «Кагоцел» подтверждено в ходе доклинических исследований. Дополнительным подтверждением безопасности препарата может служить отсутствие высвобождения молекул свободного госсипола в организме человека из активной субстанции препарата под воздействием пищеварительных соков.
Цель работы – оценка содержания свободного госсипола в препарате «Кагоцел» после воздействия на него стандартных модельных сред – имитаторов желудочного и кишечного сока человека, а также после инкубации препарата в среде, содержащей активную микробную целлюлазу.
Материал и методы. Объект исследования – лекарственный препарат «Кагоцел, таблетки 12 мг». Для контроля и количественного определения свободного госсипола в составе модельных сред использован высокочувствительный метод высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием (ВЭЖХ-МС).
Результаты. Разработана и валидирована высокочувствительная и высокоспецифичная ВЭЖХ-МС методика определения свободного госсипола в препарате «Кагоцел, таблетки 12 мг». Методика позволяет надежно детектировать свободный госсипол в жидкой среде при его концентрации в растворах в диапазоне от 0,005 до 2,500 мкг/мл. Содержание микропримесей в виде свободного госсипола в среде после 24-часового инкубирования препарата в стандартных имитаторах желудочного и кишечного соков, а также после воздействия микробной целлюлазы не возрастает.
Заключение. Высвобождения и накопления свободного госсипола после длительного инкубирования таблеток «Кагоцел» как в имитационных средах, так и в среде, содержащей микробную целлюлазу, не происходит.
Ключевые слова: кагоцел, госсипол, модельные среды, ВЭЖХ, валидация.
Introduction. Kagocel (12-mg tablets) has been designed on the basis of an oxidized cellulose polymer with grafted chemically modified molecules of the natural polyphenol gossypol. When this natural highly biologically active polyphenol is in a bound state, it loses its toxicity, by maintaining its beneficial pharmacological properties. The manufacture of Kagocel ensures thorough removal of unbounded free gossypol residues and control of the presence of the latter. Lack of toxic effects of Kagocel has been confirmed by preclinical studies. In addition, the safety of the drug can be proved by the fact that free gossypol cannot be released from the active substance of the drug in the human body under the influence of digestive juices.
Objective: to estimate the content of free gossypol in Kagocel after exposure to standard model environments, such as human gastric and intestinal juice simulants, as well as after incubation of the drug in the medium containing active microbial cellulase.
Material and methods. The investigation object was 12-mg tablets of Kagocel. The highly sensitive method, namely: high-performance liquid chromatography with mass spectrometric detection (HPLC-MS) was used to monitor and quantify free gossypol as part in the model media.
Results. The highly sensitive and highly specific HPLC-MS procedure was developed and validated to determine minimal quantities of residual free gossypol in Kagocel (12-mg tablets). The procedure allows reliable detection of free gossypol at solution concentrations in the range of 0.005 to 2.500 µg/ml. The content of traces as free gossypol in the medium after 24-hour incubation in standard gastric and intestinal juice simulants, as well as after exposure to microbial cellulase did not increase.
Conclusion. The release and accumulation of free gossypol do not occur after prolonged incubation of Kagocel in both simulation and microbial cellulase-containing environments.
Key words: Kagocel, gossypol, model media, high-performance liquid chromatography, validation.
Введение
Содержащийся в хлопчатнике природный полифенол госсипол давно вызывает интерес фармакологов всего мира в связи с выявленными у этого природного соединения полезными свойствами и высокой биологической активностью. Госсипол оказывает противовирусное, противоопухолевое, антиоксидантное, антимикробное, иммуномодулирующее действие1. Однако его применение в качестве лекарства ограничено из-за относительно высокой токсичности для млекопитающих2.
Тем не менее, на основе госсипола созданы и используются в клинической практике различные лекарственные средства (ЛС), среди которых наиболее широко применяемый в настоящее время противовирусный препарат «Кагоцел». Активным веществом этого препарата является уникальное соединение, представляющее собой полимерную матрицу диальдегид-карбоксиметилцеллюлозы (ДАКМЦ) с прочно присоединенными молекулами госсипола. Контроль полноты удаления исходно добавляемого в реакцию синтеза госсипола и подтверждение его отсутствия в конечном лекарственном препарате – обязательный элемент системы контроля качества субстанции и препарата «Кагоцел».
Для количественного определения госсипола существуют разные методы, включая варианты ВЭЖХ3, 4, 5, 6. Однако последние разрабатывались преимущественно для контроля наличия госсипола в составе ряда пищевых продуктов на основе хлопкового масла – природного источника этого соединения.
Ранее специалистами НИАРМЕДИК ПЛЮС и научными сотрудниками МГУ имени М.В. Ломоносова для контроля качества субстанции и препарата «Кагоцел» была разработана и валидирована методика количественного определения примесей свободного госсипола7. Указанный вариант методики ВЭЖХ с УФ-детектированием обладает высокой чувствительностью (ПКО=1,56•10-5 мг/мл). С помощью этой методики было подтверждено, что содержание остаточных примесей свободного госсипола в препарате непосредственно после изготовления, а также после хранения в течение установленного срока годности находится на уровне 0,0002 до 0,0030% от массы субстанции, что приблизительно в 20–100 раз ниже установленного основными мировыми фармакопеями и Государственной фармакопеей РФ XIII издания нижнего порога обязательного контроля единичных примесей в фармацевтических субстанциях (0,05%)8. Такой низкий уровень содержания примеси госсипола гарантирует отсутствие каких-либо нежелательных воздействий препарата «Кагоцел» на организм человека, поскольку неблагоприятные физиологические эффекты свободного госсипола наблюдаются при его поступлении в свободном виде через рот в организм человека в дозах свыше 0,12 мг/кг9. Низкая токсичность субстанции и препарата «Кагоцел», в том числе и при пероральном поступлении в организм, подтверждены специальными доклиническими исследованиями.
Одним из известных приемов исследования параметров растворения фармацевтических препаратов, предназначенных для приема внутрь, является проведение испытания по данному показателю путем помещения ЛС в специальные, так называемые имитационные среды. Последние имитируют физиологический состав желудочного и кишечного сока по показателям pH, наличию ферментных систем, а также по показателям осмолярности, ионной силы, буферной емкости и поверхностного натяжения, которые могут повлиять на стабильность активных действующих веществ в биологических жидкостях10.
Кроме регистрации кинетики растворения, применение подобных сред позволяет одновременно оценить и наличие каких-либо изменений самого фармакологически активного ингредиента под действием компонентов имитационной среды18. Такое исследование препарата на основе полимерной субстанции «Кагоцел» будет также способствовать выяснению вопроса о возможности «выщепления» молекул связанного госсипола в результате продолжительного воздействия компонентов такой имитационной среды.
Цель работы — отработать и валидировать в соответствии с современными требованиями высокочувствительную и специфичную методику ВЭЖХ-анализа, пригодную для обнаружения минимальных примесей свободного госсипола, в том числе в составе модельных сред. Оценить содержание свободного госсипола в препарате «Кагоцел» до и после воздействия на него стандартных сред — имитаторов желудочного и кишечного сока человека, а также после инкубации препарата в среде, содержащей активную микробную целлюлазу.
Материалы и методы
Объектом исследования служили образцы таблеток препарата «Кагоцел, таблетки 12 мг» (производственная серия 0250216).
В качестве стандартного образца госсипола в работе использовали коммерческий реактив госсипола «Sigma Aldrich» (кат. № G8761) с содержанием основного вещества не менее 95%.
Реактивы для ВЭЖХ. Для приготовления подвижной фазы при проведении хроматографического исследования применяли ацетонитрил (900667 SigmaAldrich), муравьиную кислоту (17186 Sigma-Aldrich), этанол (ГОСТ 5962-2013), ацетон (650501 SigmaAldrich), ледяную уксусную кислоту (64-19-7 SigmaAldrich), воду деионизированную (Milli-Q). Все растворы перед введением в хроматограф фильтровали через мембранный фильтр PTFE (политетрафторэтилен) с размером пор 0,45 мкм.
Приготовление испытуемых растворов. Для проведения исследований на содержание свободного госсипола таблетки препарата «Кагоцел» истирали в ступке до состояния пудры. В пластиковую пробирку объемом 15 мл помещали точную навеску образца массой 0,350–0,450 г, добавляли 2 мл воды, вносили 2 мл смеси ацетонитрил/CH3COOHлед (99,2/0,8 об./об.), перемешивали 30 с на высокоскоростном шейкере-вортексе, инкубировали в течение 10 мин на орбитальном шейкере при комнатной температуре (20—25°С) в скоростном режиме 260 об/мин. Образец инкубировали 2 ч при температуре −15—-18°С, с помощью шприца (вместимостью 5 мл) с длинной иглой отбирали жидкую фазу, фильтровали через одноразовый мембранный PTFE-фильтр с диаметром пор 0,45 мкм. Анализируемый раствор хранили во флаконе из темного стекла при температуре не выше 10°C не более 3 ч.
Приготовление раствора сравнения. Навеску стандартного образца госсипола массой 0,0010 г помещали в мерную колбу, растворяли в 2–4 мл смеси ацетонитрил/CH3COOHлед (99,2/0,8 об./об.), перемешивали, доводили объем до 10 мл той же смесью (раствор А, 100 мкг/мл). Раствор Б представлял собой разбавленный в 10 раз ацетонитрилом раствор А. Растворы хранили в темноте при температуре −10—-18°С не более 1 сут.
Приготовление модельных сред. Модельные (имитационные) среды простого состава (основные ингредиенты – солевой буфер и соответствующий основной пищеварительный фермент) готовили и применяли в соответствии с рекомендациями ведущих зарубежных фармакопей11, 12.
Состав имитатора желудочного сока (ИЖС) (pH среды – 1,2):
• пепсин очищенный «Carl Roth» (2000 ед/г) – 0,32г;
• NaCl – 0,20 г;
• HCl конц. – 0,7 мл;
• вода очищенная до 100 мл.
Состав имитатора кишечного сока (ИКС)(pH среды – 6,8):
• панкреатин «PanReac» (35000 ед/г) – 1,0 г;
• KH2PO4 – 0,68 г;
• NaOH, 0,2М – 7,7 мл.
Состав модельной среды с целлюлазной активностью: среда на основе 0,1 М ацетатного буфера (pH 5,0) с добавлением коммерческого препарата «Агроцелл» («Агрофермент»), включающего комплекс ферментов микробного происхождения. Препарат стандартизуется по целлюлазной активности — не менее 4000 ед/г; помимо этого, гарантируются активности: β-глюканазная — 3200 ед/г; ксиланазная — 1000 ед/г13.
Испытание влияния инкубации в модельных средах на препарат «Кагоцел». Для каждой модельной среды готовили 2 параллельные пробы: в мерную колбу объемом 25 мл, изолированную от света фольгой, вносили точную навеску диспергированного исследуемого образца порошка растертых таблеток «Кагоцел» массой 4,5–5,5 г, добавляли 15 мл среды, перемешивали (не взбалтывая) до состояния однородной суспензии, объем доводили до метки, интенсивно перемешивали в течение 1 мин, избегая образования пены (суспензия МС). Колбы устанавливали в термостатированный орбитальный шейкер, и непрерывно перемешивали (скорость 260 об/мин) при температуре 37°С.
Пробы объемом 4 мл каждая отбирали через заданные промежутки времени (0, 3 и 24 ч). Для проведения хроматографического исследования отобранных образцов к ним добавляли 4 мл смеси ацетонитрил/CH3COOHлед (99,2/0,8 об./об.), и далее обрабатывали, согласно описанию приготовления испытуемых растворов применительно к таблеткам (см. выше). Образцы хранили при температуре не выше 10°C не более 3 ч.
ВЭЖХ-анализ проб выполняли на жидкостном хроматографе Agilent 1290, оборудованном двухканальным насосом Agilent Technologies 1290 Infinity Binary Pump; блоком для термостатирования; хроматографической колонкой Agilent Technologies 1290 Infinity TCC; автосамплером Agilent Technologies 1290 Infinity Sampler; тройным квадрупольным масс-спектрометрическим детектором Agilent Technologies 6460 Triple Quad LC/MS c источником ионов типа электроспрей Jet Stream ESI.
Разделение выполняли на хроматографической колонке Agilent С18 SB-Aq 2,1×50 мм, заполненной октадецилсилильным эндокепированным силикагелем для хроматографии (C18) с размером частиц 1,8 мкм. В ходе исследования колонку поддерживали при постоянной температуре 40°С. Объем пробы для анализа — 5 мкл; скорость элюирования — 0,4 мл/мин.
Результаты и обсуждение
Разработка и валидация методики количественного определения примесей свободного госсипола
Для определения свободного госсипола в составе лекарственного препарата «Кагоцел», в том числе и после его помещения в модельные среды, выбрали вариант ВЭЖХ с масс-спектрометрическим детектированием (ВЭЖХ-МС), как наиболее чувствительный и специфичный биоаналитический метод.
На 1-м этапе исследований отрабатывали условия испытаний лекарственного препарата «Кагоцел» на наличие свободного госсипола. В ходе отработки и валидации методики в качестве стандартного образца (СО) использовали коммерческий препарат очищенного госсипола. При этом анализ методом ВЭЖХ-МС выполняли в условиях детектирования специфического для госсипола иона размером 517.2 а.е.м. (рис. 1).
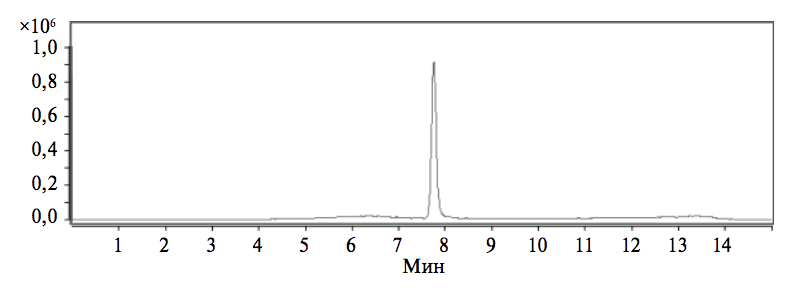
Результаты предварительных экспериментов подтвердили высокую чувствительность метода и его пригодность для количественной оценки содержания госсипола в средах.
С учетом данных литературы о значительной нестабильности растворов госсипола в ряде органических растворителей14 в ходе отработки условий выполнения методики также осуществляли выбор оптимального состава подвижной фазы для хроматографии. При этом предварительно были получены данные, подтвердившие стабильность на уровне не менее 97–98% от исходной концентрации растворов госсипола (0,2 мкг/мл) в ацетоне, ацетонитриле и в смеси ацетонитрил–уксусная кислота (99,2/0,8 об./об.) в течение 3 ч.
Кроме того, выбор оптимальной для проведения исследований системы растворителей в составе подвижной фазы был обусловлен полученными в ходе отработки методики результатами оценки эффективности экстракции примесей свободного госсипола из порошка растертых таблеток препарата (табл. 1).
| Экстрагент | Среднее значение содержания свободного госсипола, нг/мг препарата |
|---|---|
| Ацетонитрил | 0,01 |
| Ацетонитрил/уксусная кислота (99,2/0,8 об./об.) | 0,01 |
| Вода | 0,19 |
| Ацетонитрил/вода (50/50 об./об.) | 1,09 |
| Ацетонитрил/уксусная кислота (99,2/0,8 об./об.) + равный объем воды | 1,17 |
Таким образом, максимальный эффект извлечения из таблеток препарата имеют системы растворителей (ацетонитрил/уксусная кислота (99,2/0,8 об./ об.) – вода (50/50 об./об.) или ацетонитрил–вода (50/50 об./об.).
Для дальнейших экспериментов в качестве подвижной фазы для хроматографии использовали систему растворителей (ацетонитрил/уксусная кислота (99,2/0,8 об./об.) – вода (50/50 об./об.).
На следующем этапе определяли оптимальные условия пробоподготовки и проведения ВЭЖХ-МС-анализа наличия примесей свободного госсипола в таблетках лекарственного препарата «Кагоцел». В ходе этих исследований были отработаны условия для отделения нерастворимых компонентов из состава вспомогательных веществ, содержащихся в таблетках препарата. При этом с использованием модельных смесей было подтверждено сохранение количественного характера извлечения из таблеток добавляемых примесей госсипола.
В условиях эксперимента сохранялись высокая чувствительность и специфичность анализа, при котором содержащиеся в препарате вспомогательные вещества не оказывали существенного влияния на результаты исследования (рис. 2).
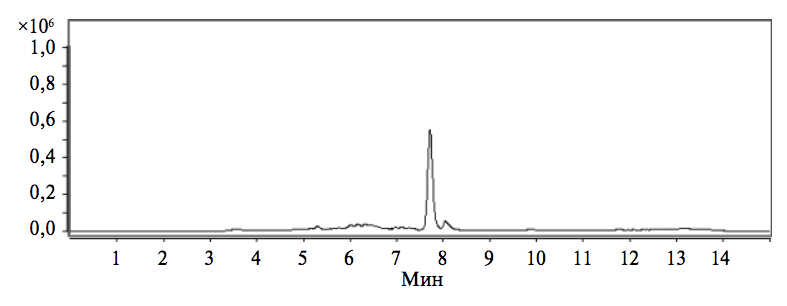
После отработки условий выполнения анализа осуществляли валидацию методики хроматографического определения содержания свободного госсипола в лекарственном препарате «Кагоцел». При этом, согласно рекомендациям ГФ XIII, методика оценивалась по следующим параметрам: специфичность, предел обнаружения и количественного определения, линейность и аналитический диапазон, правильность, прецизионность.
Специфичность методики обнаружения анализируемого вещества (госсипол) в исследуемых образцах подтвердили путем сопоставления результатов исследования проб, приготовленных отработанным способом из порошка растертых таблеток, с результатами исследования СО госсипола (см. рис. 1 и 2). Эти данные не выявили негативного влияния вспомогательных веществ в таблетках «Кагоцела» на результаты количественного определения содержания свободного госсипола.
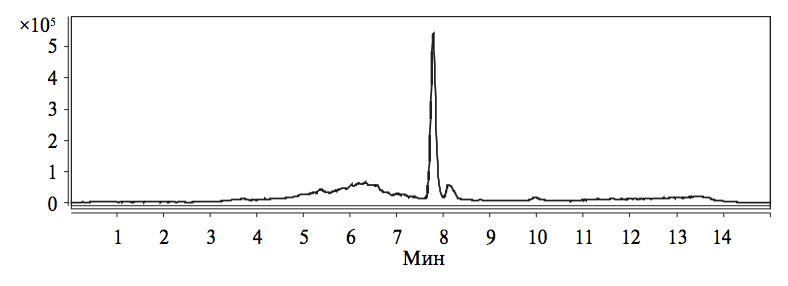
Аналогичным образом было подтверждено отсутствие мешающего действия компонентов модельных сред на результаты обнаружения госсипола (рис. 3).
Линейность отработанной методики рассчитывали вычислением площадей пиков определяемого вещества на хроматограммах, полученных для серии из 9 растворов СО с содержанием госсипола в диапазоне концентраций от 0,0050 до 2,500 мкг/мл.
Установлено, что зависимость площади пика СО госсипола от его концентрации имеет линейную зависимость во всем диапазоне исследуемых концентраций госсипола (рис.4).
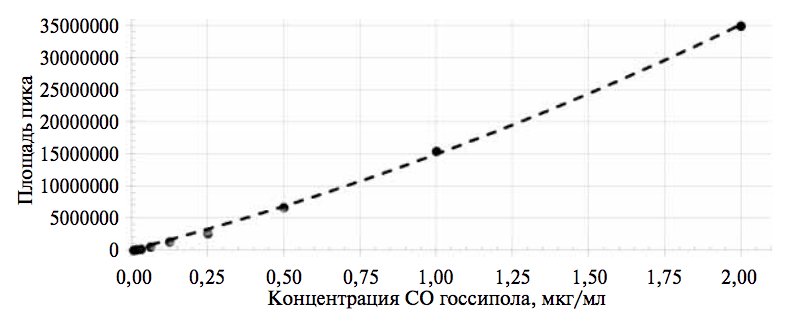
На основании этих данных показатель предела обнаружения был принят равным 0,003 мкг/мл, а нижний предел количественного определения (ПКО) свободного госсипола составил 0,01 мкг/мл.
Правильность методики устанавливали методом добавок с использованием 3 испытуемых модельных растворов смеси растертых таблеток «Кагоцел» с добавлением к ним в соотношении 1:1 об. возрастающих количеств СО госсипола. При этом использовали модельные смеси с концентрациями специфической примеси 50, 100, 150% от установленного верхнего значения максимально зарегистрированного содержания госсипола в таблетках «Кагоцел» (0,12 мкг в одной таблетке). Всего было приготовлено и проанализировано 9 образцов. Согласно полученным данным (табл. 2), открываемость находится в пределах установленной для валидационных испытаний нормы.
| Концентрация госсипола в испытуемом растворе, мкг/мл | Добавлено раствора СО с концентрацией, мкг/мл |
Ожидаемое значение (В), мкг/мл |
Полученное значение (А), мкг/мл |
Абсолютная ошибка, мкг/мл |
R, % |
|---|---|---|---|---|---|
| 0,254 | 0,100 | 0,177 | 0,178 | 0,001 | 100,7 |
| 0,254 | 0,300 | 0,277 | 0,295 | 0,018 | 106,5 |
| 0,311 | 0,400 | 0,355 | 0,388 | 0,032 | 109,1 |
| 0,311 | 0,100 | 0,205 | 0,217 | 0,012 | 105,7 |
| 0,291 | 0,300 | 0,296 | 0,285 | -0,011 | 96,4 |
| 0,291 | 0,400 | 0,346 | 0,365 | 0,020 | 105,7 |
| 0,291 | 0,100 | 0,196 | 0,190 | -0,006 | 96,9 |
| 0,291 | 0,300 | 0,296 | 0,269 | -0,027 | 90,9 |
| 0,338 | 0,400 | 0,369 | 0,370 | 0,001 | 100,1 |
| Среднее значение выхода, % | 101,3 | ||||
Аналогичным образом оценка показателя правильности применительно к анализу искусственных смесей модельных сред с добавленными количествами (от 0,2 до 0,5 мкг/мл) раствора СО госсипола показала достаточный уровень открываемости (табл 3).
| Название | № | Среда | Среда с добавкой СО госсипола (процент восстановления, R%) |
|---|---|---|---|
| Имитатор желудочного сока | 1 | Не обнаружено | 92,3 |
| 2 | То же | 93,8 | |
| Среднее | –"– | 93,1 | |
| Имитатор кишечного сока | 1 | –"– | 109,8 |
| 2 | –"– | 106,8 | |
| Среднее | –"– | 108,3 | |
| Среда с целлюлазой | 1 | –"– | 99,1 |
Прецизионность методики оценивали по показателям сходимости и воспроизводимости метода, коэффициенты вариации которых по 6 измерениям составили 4,32 и 5,05% соответственно, что удовлетворяет установленным критериям для этих показателей.
Как показали результаты проведенных исследований, предлагаемая методика признана удовлетворяющей установленным ГФ XIII валидационным критериям (табл. 4).
| Параметр | Оценка | Пояснение |
|---|---|---|
| Специфичность | Положительно | Время удерживания (tr): 7,759±0,015 |
| Линейность | То же | Коэффициент корреляции (R2): 0,99918. Степень аппроксимации: хорошая |
| Правильность (точность) | –"– | Диапазон процента восстановления (R%): 90,9–109,1 |
| Сходимость (повторяемость) | –"– | Коэффициент вариации (СV, %): 4,32 |
| Воспроизводимость | –"– | Коэффициент вариации (CV, %): 5,05 |
Анализ возможности высвобождения свободного госсипола из препарата «Кагоцел» при инкубации в модельных средах
В соответствии с описанными условиями (см. раздел «Материал и методы») в ходе испытания отбор проб осуществляли сразу после добавления испытуемого образца порошка таблеток «Кагоцел» в модельные среды, а также через 3 и 24 ч инкубации. Количество госсипола в препарате «Кагоцел» после воздействия модельных сред рассчитывали валидированным методом ВЭЖХ-МС. Результаты количественной оценки содержания свободного госсипола в составе всех испытанных модельных сред приведены в табл. 5.
| Модельная среда | Проба | Время инкубации, ч | ||
|---|---|---|---|---|
| 0 | 3 | 24 | ||
| Имитатор желудочного сока | 1 | 0,69 | 0,44 | 0,29 |
| Линейность | 2 | 0,54 | 0,29 | 0,17 |
| Правильность (точность) | Среднее | 0,62 | 0,36 | 0,23 |
| Имитатор кишечного сока | 1 | 1,21 | 0,61 | 0,47 |
| 2 | 1,04 | 0,57 | 0,22 | |
| Среднее | 1,13 | 0,59 | 0,34 | |
| Среда с целлюлазой | 1 | 0,82 | 0,66 | 0,42 |
| 2 | 0,88 | 0,67 | 0,43 | |
| Среднее | 0,85 | 0,67 | 0,42 | |
Таким образом, в результате выполненных экспериментов с использованием отработанной и валидированной высокоспецифичной и чувствительной ВЭЖХ-МС методики показано, что препарат «Кагоцел» (таблетки 12 мг) характеризуется очень низким [на уровне не выше 1–2 нг на 1 мг массы таблетки или примерно (1-2)•10-3 масс.%] уровнем содержания примеси свободного госсипола. Это во много раз ниже минимальных значений, которые подлежат контролю при анализе фармацевтического качества препаратов (для активных субстанций — 0,05% по массе), согласно требованиям ведущих зарубежных фармакопей и ГФ РФ XIII8.
При указанных уровнях содержания свободного госсипола в таблетках «Кагоцела», с учетом инструкции по применению препарата и суточной его дозировки, поступление в организм госсипола в виде содержащихся в препарате примесей не превысит 0,7 мкг в сутки, что примерно в 10000 раз ниже величины, установленной Европейской комиссией по безопасности питания: минимальное суточное количество госсипола, поступающее с некоторыми пищевыми продуктами , которое может негативно влиять на репродуктивную систему человека, составляет примерно 7–8 мг в сутки9.
Результаты экспериментов с применением стандартных, рекомендованных ведущими фармакопеями модельных сред, имитирующих пищеварительные соки человека (ИЖС, ИКС), подтвердили, что при длительном (до 24 ч) воздействии на препарат модельных сред количество госсипола в растворе не возрастало. Воздействие на препарат «Кагоцел» (активное вещество — субстанция на основе окисленного производного КМЦ) модельной среды с добавлением комплекса микробных ферментов — целлюлазы, β-глюканазы и ксиланазы — также не сопровождалось увеличением в среде количества свободного госсипола.
Более того, в процессе инкубации количество госсипола во всех модельных средах (в пересчете на массу внесенного препарата) существенно снижалось, причем этот эффект со временем усиливался. Причины этого явления точно не установлены. Однако из данных литературы известно, что госсипол в водных растворах, особенно при его низкой концентрации, является относительно нестабильным веществом, подвергаясь различным реакциям химической и фотохимической деградации14, 15, 16, 17.
Заключение
Отработана и валидирована в соответствии с современными фармакопейными требованиями ВЭЖХ-МС методика определения примесей свободного госсипола в препарате таблеток «Кагоцел». Методика характеризуется высокой чувствительностью (порог количественного определения – 0,01 мкг/мл) и специфичностью. Подтверждены условия выполнения методики для выявления госсипола в сложных по составу модельных (имитационных) средах.
В процессе длительной (до 24 ч) инкубации препарата «Кагоцел» в модельных средах, имитирующих пищеварительные соки человека, а также в среде, содержащей активную микробную целлюлазу, не выявлено увеличения содержания примесей свободного госсипола.
Работа выполнена с использованием научного оборудования Центра коллективного пользования «Промышленные биотехнологии» и АЦКП «Биоинженерия» Федерального исследовательского центра Биотехнологии РАН.
Литература/References
- Wang X., Howell C.P., Chen F., Yin J., Jiang Y. Gossypol-a polyphenolic compound from cotton plant. Advances in food and nutrition research. 2009. Vol. 58: 215–63.
- Zhang W.J., Xu Z.R., Pan X.L., Yan X.H., Wang Y.B. Advances in gossypol toxicity and processing effects of whole cottonseed in dairy cows feeding. Livestock Science 111.1 (2007): 1–9.
- Hongxia Lin, Gounder M. K., Bertino J.R., Ah-Ng Tony Kong, DiPaola R.S., Steina M.N. A validated HPLC assay for the determination of R-(–)- gossypol in human plasma and its application in clinical pharmacokinetic studies //Journal of pharmaceutical and biomedical analysis. – 2012. – Vol. 66.:371–5.
- Yingfan Cai, Hong Zhang, Yu Zeng, Jianchuan Mo, Jinku Bao, Chen Miao, Jie Bai, Fang Yan and Fang Chen. An optimized gossypol high-performance liquid chromatography assay and its application in evaluation of different gland genotypes of cotton. Journal of Biosciences. 2004. Vol. 29, 1: 67–71.
- Chandrashekar R., Karunakar Rao Kudle, Jyothi Chaitanya P. and Lakshmi Bhavani N.. Gossypol analysis in Bt and non-Bt cotton seed extracts by high-performance liquid chromatography (HPLC). International journal of herbal medicine. 2013. Vol. 1, 2: 53–8.
- Khodwe M. S., Bhowmick D. N. Separation of gossypol from cottonseed and preparation of gossypol-free cottonseed cake. International Journal of Recent Scientific Research. 2013. Vol. 4, 8: 1290–5.
- Киселева И.В., Рудой Б.А., Пирогов А.В., Толмачева Н.Г. Валидация ВЭЖХ-методики определения госсипола в субстанции «Кагоцел». Фармация. 2016. Т. 65, 8: 18–24. [ Kiseleva I.V., Rudoi B.A., Pirogov A.V., Tolmacheva N.G. Validation of an HPLC method of evaluation of gossypol in the substance of «Kagocel». Farmatsiya. 2016. Vol. 65, 8: 18-24] (in Russian)].
- Государственная фармакопея Российской Федерации. XIII издание. Т.1. М., 2015: 178–87. [State Pharmacopeia of the Russian Federation, XIII-th ed. Vol.1. Moscow., 2015: 178–87 (in Russian)].
- Scientific opinion. Gossypol as undesirable substance in animal feed. The EFSA Journal, 2008; 908: 1–55.
- Klein S. The use of biorelevant dissolution media to forecast the in vivo performance of a drug. The AAPS journal. 2010. Vol. 12, 3: 397–406.
- USP Dissolution Methods Database Updated Mar 2, 2017, with the release of the First Suppl. of USP 40 – NF 35.
- Recommendations on methods for dosage forms testing European Pharmacopoeia 7.0 Vol: 665–6.
- Агроцелл. Инструкция по применению. 2012. [Agrocell. Instruction for users. 2012 (in Russian)].
- Nomeir A.A., Abou-Donia M.B. Gossypol: High-Performance Liquid Chromatographic Analysis and Stability in Various Solvents. JAOCS. 1982.Vol. 59, 12: 547 .
- Kenar J. A. Reaction chemistry of gossypol and its derivatives. Journal of the American Oil Chemists' Society. 2006. Vol. 83, 4: 269–302.
- Nomeir A.A., Abou-Donia M.B. Photodecomposition of Gossypol by Ultraviolet Irradiation. JAOCS. 1985. Vol. 62: 1.
- Gossypol and its derivatives and their complexes in solutions. Ziyaev Kh. L., Baram N.I., Khodzhaniyazov B., Kamaev F.G., Biktlmirov L., Dzhurabekova S.B. , Ismailov A.I. Chemistry of Natural Compounds. 1998. Vol. 34, 1: 52–6.
- Assessment of enzymatic prodrug stability in human, dog and simulated intestinal fluids. Borde A.S, Karlsson E.M., Andersson K, Björhall K, Lennernäs H, Abrahamsson B. Eur J Pharm Biopharm. 2012. Vol. 80(3):630-7.
